Développement Cortical & Microcéphalies
Comment le cerveau humain se développe depuis les stades embryonnaires jusqu’à l’âge adulte, et comment il atteint sa taille et son organisation finales sont au cœur de nos questions scientifiques. Notre groupe s’intéresse au développement cortical et, en particulier, aux anomalies du développement qui conduisent à la microcéphalie humaine, un trouble neurodéveloppemental relativement fréquent qui se manifeste par un déficit du développement cérébral congénital (microcéphalies primaires) ou postnatal (microcéphalies secondaires) et qui peut résulter de variants génétiques ou de causes environnementales au cours de la grossesse. Pour modéliser ces pathologies et disséquer les mécanismes cellulaires et moléculaires en cause, nous développons des organoïdes corticaux à partir de cellules pluripotentes induites (hiPSCs) issues des cellules de patients atteints de microcéphalies
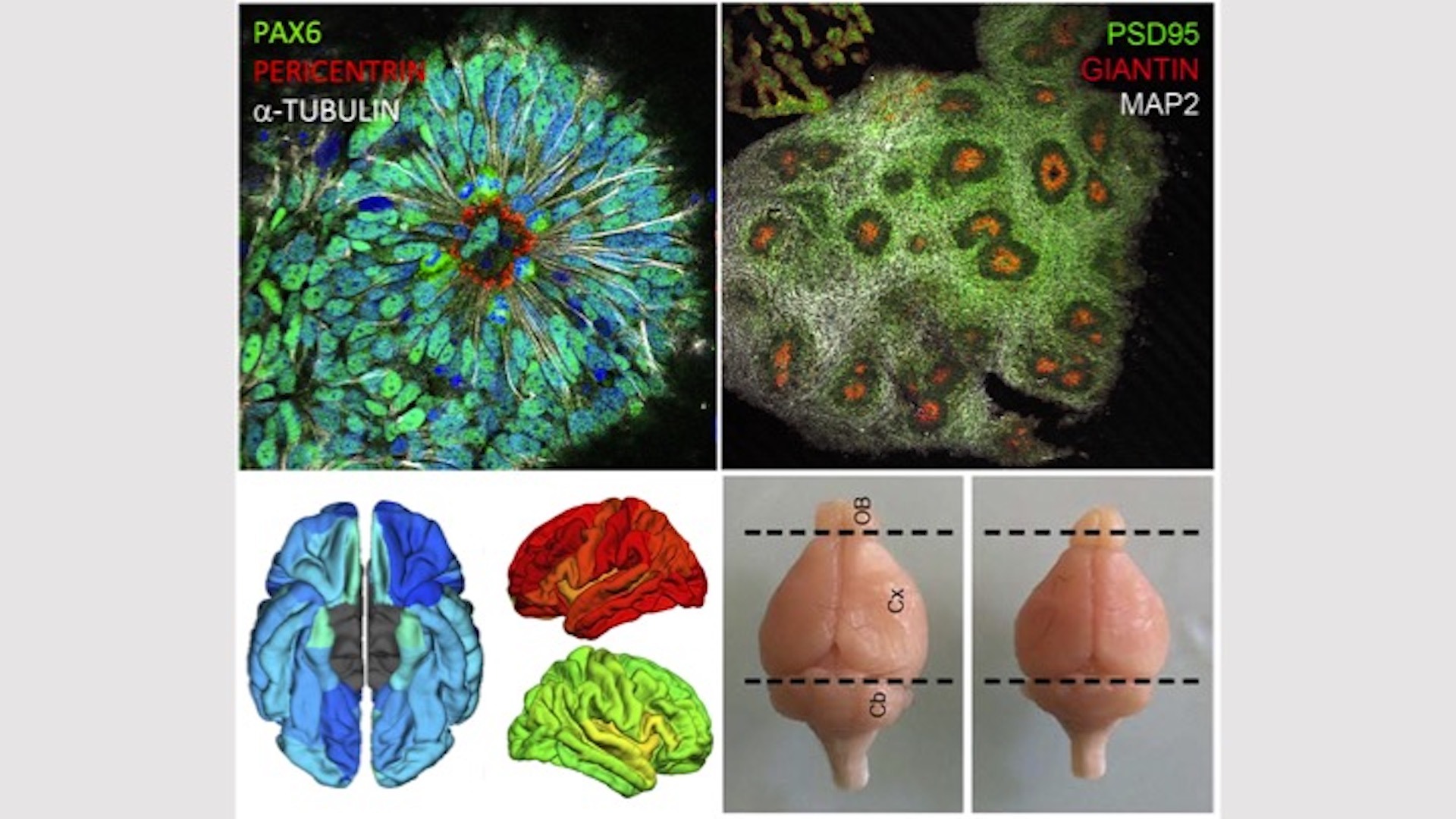
Nous avons identifié des défauts de centrosomes au cours de la corticogenèse et des anomalies de transport golgien comme des causes récurrentes de microcéphalie et notre groupe a largement contribué à l’identification de plusieurs gènes de microcéphalie associés à des anomalies du centrosome (Passemard, Neurology 2009; Nicholas, Nat Genet 2010; Harding, Am J Hum Genet 2016; Létard, Hum Mutat 2018) ou de l’appareil de Golgi (Dimitrov, Hum Mol Genet 2009; Dupuis, Hum Mutat 2013; Izumi, Am J Hum Genet 2016; Uwineza, Eur J Med Genet 2019). Les produits des gènes impliqués dans les centrosomopathies ont clairement un rôle dans la régulation du cycle cellulaire et dans la dynamique du fuseau mitotique au cours de la division des progéniteurs neuraux, tandis que ceux des gènes associés aux Golgipathies semblent importants pour le trafic des vésicules pré ou post-golgiennes. Ceci suggère que des patho-mécanismes très différents peuvent conduire à la microcéphalie. Récemment, des anomalies du métabolisme mitochondrial ont aussi été caractérisées dans certaines microcéphalies.
Objectifs Scientifiques
Notre groupe s’intéresse à :
1. la caractérisation phénotypique et moléculaire de nouvelles centrosomopathies et Golgipathies
2. la compréhension des rôles physiopathologiques du centrosome, de l’appareil de Golgi et de la mitochondrie dans le développement des microcéphalies
Expertise & Méthodologie
Nos approches expérimentales incluent :
1. l’imagerie cérébrale
2. la modélisation du développement cérébral à partir d’organoïdes dérivés de cellules pluripotentes induites humaines (hiPSCs) de patients et l’ingénierie du génome CRISPR/Cas
3. la modélisation de pathologies cérébrales à travers des modèles murins invalidés pour les gènes d’intérêt
4. l’oxymétrie, la spectrophotométrie et la spectrofluorimétrie
Membres Permanents
Albert Alexandra, AI Inserm
Drunat Séverine, PH APHP
El Ghouzzi Vincent, DR CNRS
Jacquier Sandrine, AI Inserm
Lebon Sophie, IR Inserm
Le Guilloux Gwendoline, AI Inserm
Lévy Jonathan, PH APHP
Masson Justine, CRHC CNRS
Moussay Manon, IR Inserm
Papp Bela, CRCN Inserm
Passemard Sandrine, PUPH APHP
Rak Malgorzata, CRCN CNRS
Verloes Alain, PUPH APHP
Vial Yoann, MCUPH APHP
Publications
- Albert A., Couture L., Piumi F., Lebon S., Gressens P., Coulpier M., Amara A., El Ghouzzi V*., Meertens L*. Oropouche virus infects human neural progenitor cells and alters the growth of brain organoids. BioRxiv 2025
- Lebon S., Bruneel A., Drunat S., Albert A., Csaba Z., Elmaleh M., Ntorkou A., Ténier Y., Fenaille F., Gressens P., Passemard S., Boespflug-Tanguy O., Dorboz I., El Ghouzzi V. A biallelic variant in GORASP1 causes a novel Golgipathy with glycosylation and mitotic defects. Life Sci. Alliance, 2025 Feb 11;8(4)
- Gins C., Guimiot F., Drunat S., Prévost C., Rosenblatt J., Capri Y., Letard P., Khung-Savatovsky S., Mahi Henni M.A., Chafai Elalaoui S., Alison M., Guilmin Crepon S., Gressens P., Verloes A., Basto R., El Ghouzzi V., Passemard S. Radial microbrain (micrencephaly) is caused by a recurrent variant in the RTTN gene. Neurol. Genet., 2025, 11, e200221.
- Nava C., Cogne B., Santini A., Leitão E., Lecoquierre F., Chen Y., Stenton S.L., Besnard T., Heide S., Baer S., Jakhar A., …, Delahaye-Duriez A…..Passemard S….Depienne C. Dominant variants in major spliceosome U4 and U5 small nuclear RNA genes cause neurodevelopmental disorders through splicing disruption Nat. Genet., 2025 Jun;57(6):1374-1388.
- Pedraza M., Grampa V., Scotto-Lomassese S., Puech J., Muzerelle A., Mohammad A., Lebon S., Renier N., Métin C., Masson J. The ciliary kinesin KIF7 controls the development of the cerebral cortex by acting differentially on SHH-signaling in dorsal and ventral forebrain. eLife, 2025, 13, RP100328.
- Tóth S, Kaszás D, Sónyák J, Tőkés AM, Padányi R, Papp B, Nagy R, Vörös K, Csizmadia T, Tordai A, Enyedi Á. he calcium pump PMCA4b promotes epithelial cell polarization and lumen formation. Commun Biol. 2025 Mar 12;8(1):421.
- Clin. Genet. 2024 Jul;106(1):90-94.
- Adle-Biassette H., Ricci R., Martin A., Martini M., Ravegnini G., Kaci R., Gélébart P., Poirot B., Sándor Z., Lehman-Che J., Tóth E., Papp B. Sarco/endoplasmic reticulum calcium ATPase 3 (SERCA3) expression in gastrointestinal stromal tumours. Pathology. 2024 Apr;56(3):343-356.
- Zatyka M, Rosenstock TR, Sun C, Palhegyi AM, Hughes GW, Lara-Reyna S, Astuti D, di Maio A, Sciauvaud A, Korsgen ME, Stanulovic V, Kocak G, Rak M, Pourtoy-Brasselet S, Winter K, Varga T, Jarrige M, Polvèche H, Correia J, Frickel EM, Hoogenkamp M, Ward DG, Aubry L, Barrett T, Sarkar S. Depletion of WFS1 compromises mitochondrial function in hiPSC-derived neuronal models of Wolfram syndrome. Stem Cell Rep. 2023 May 9;18(5):1090-1106.
- Farcy S., Hachour H., Bahi-Buisson N., Passemard S. Cells, 2023, 12, 1807.
-
Am J Hum Genet. 2023 Apr 6;110(4):663-680.
- El Ghouzzi V., Boncompain G. Golgipathies reveal the critical role of the sorting machinery in brain and skeletal development Nat. Commun., 2022, 13, 7397.
- Farcy S., Albert A., Gressens P., Baffet A.*, El Ghouzzi V*. Cortical Organoids to Model Microcephaly. Cells, 2022 , 11, 2135.
- Ruaud L., Drunat S., Elmaleh-Berges M., Ernault A., Crepon SG., El Ghouzzi V., Auvin S., Verloes A., El Ghouzzi V. Neurological outcome in WDR62 primary microcephaly. Dev. Med Child Neurol., 2022, 64, 509-517.
- Masson J., El Ghouzzi V. Golgi dysfunctions in ciliopathies Cells, 2022, 11, 2773.
- Nasser H., Vera L., Elmaleh-Bergès M., Steindl K., Létard P., Teissier N., Ernault A., Guimiot F., Afenjar A., Moutard M.L., Héron D., Alembik Y., Montchilova M., Milani P., Rigaudière F., Kubis N., Pouvreau N., Gressens P., Verloes A., Rauch A., El Ghouzzi V., Drunat S., Passemard S. CDK5RAP2 primary microcephaly is associated with hypothalamic, retinal and cochlear developmental defects. J. Med. Genet. 2020, 57, 389-399
- Diaz J, Gérard X, Emerit MB, Areias J, Geny D, Dégardin J, Simonutti M, Guerquin MJ, Collin T, Viollet C, Billard JM, Métin C, Hubert L, Larti F, Kahrizi K, Jobling R, Agolini E, Shaheen R, Zigler A, Rouiller-Fabre V, Rozet JM, Picaud S, Novelli A, Alameer S, Najmabadi H, Cohn R, Munnich A, Barth M, Lugli L, Alkuraya FS, Blaser S, Gashlan M, Besmond C, Darmon M, Masson J. YIF1B mutations cause a post-natal neurodevelopmental syndrome associated with Golgi and primary cilium alterations. Brain, 2020 Oct 1;143(10):2911-2928.
- Chrétien D, Bénit P, Leroy C, El-Khoury R, Park S, Lee JY, Chang Y-T, Lenaers G, Rustin P, Rak M. Pitfalls in Monitoring Mitochondrial Temperature Using Charged Thermosensitive Fluorophores. Chemosensors 2020, 8, 124
- Passemard S., Perez F., Gressens P., El Ghouzzi V. Endoplasmic reticulum and Golgi stress in microcephaly. Cell Stress, 2019, 3, 369-384.
- Uwineza A., Caberg J.H., Hitayezu J., Wenric S., Mutesa L., Vial Y., Drunat S., Passemard S., Verloes A., El Ghouzzi V., Bours V. VPS51 biallelic variants cause microcephaly with brain malformations. Eur. J. Med. Genet., 2019, 62, 103704-708.
- Bénit P, Kahn A, Chretien D, Bortoli S, Huc L, Schiff M, Gimenez-Roqueplo AP, Favier J, Gressens P, Rak M, Rustin P. Evolutionarily conserved susceptibility of the mitochondrial respiratory chain to SDHI pesticides and its consequence on the impact of SDHIs on human cultured cells. PLoS One 2019 Nov 7;14(11):e0224132
- Benlamara S, Aubry L, Fabregue J, Bénit P, Rustin P, Rak M. Distinctive Krebs cycle remodeling in iPSC-derived neural and mesenchymal stem cells. Biochem. Biophys. Res. Commun. 2019 Apr 9;511(3):658-664
- Rasika S., Passemard S., Verloes A., Gressens P., El Ghouzzi V. Golgipathies in neurodevelopment : A new view of old defects. Dev. Neurosci., 2018, 40, 396-416.
- Létard P., Drunat S., Vial Y., Duerinckx S., Ernault A., Amram D., Arpin S., Bertoli M., Busa T., Ceulemans B., Desir J., Doco-Fenzy M., Chafai Elalaoui S., Devriendt K., Faivre L., Francannet C., Geneviève D., Gérard M., Gitiaux C., Julia S., Lebon S., Lubala T., Mathieu-Dramard M., Maurey H., Metreau J., Nasserereddine S., Nizon M., Pierquin G., Pouvreau N., Rivier-Ringenbach C., Rossi M., Schaefer E., Sefiani A., Sigaudy S., Sznajer Y., Tunca Y., Guilmin Crepon S., Alberti C., Elmaleh-Bergès M., Benzacken B., Wollnick B., Woods G, Rauch A., Abramowicz A., El Ghouzzi V., Gressens P., Verloes A., Passemard S. Autosomal recessive primary microcephaly due to ASPM mutations: an update. Hum. Mutat., 2018, 39, 319-332.
- Patwardhan D., Mani S., Passemard S., Gressens P., El Ghouzzi V. STIL balancing microcephaly and cancer. Cell Death Dis., 2018, 9, 65-76.
- Chrétien D, Bénit P, Ha HH, Keipert S, El-Khoury R, Chang YT, Jastroch M, Jacobs HT, Rustin P, Rak M. Mitochondria are physiologically maintained at close to 50 °C. PLoS Biol. 2018 Jan 25;16(1):e2003992
- Passemard S., Perez F., Colin-Lemesre E., Rasika S., Gressens P., El Ghouzzi V. Golgi trafficking defects in postnatal microcephaly: The evidence for “Golgipathies”. Prog. Neurobiol., 2017, 153, 46-63.
- Cavallin M., Rujano M.A., Bednarek N., Medina-Cano D., Bernabe Gelot A., Drunat S., Maillard C., Garfa-Traore M., Bole C., Nitschké P., Beneteau C., Besnard T., Cogné B., Eveillard M., Kuster A., Poirier K., Verloes A., Martinovic J., Bidat L., Rio M., Lyonnet S., Reilly M.L., Boddaert N., Jenneson-Liver M., Motte J., Doco-Fenzy M., Chelly J., Attie-Bitach T., Simons M., Cantagrel V., Passemard S., Baffet A., Thomas S., Bahi-Buisson N. WDR81 mutations cause extreme microcephaly and impair mitotic progression in human fibroblasts and Drosophila neural stem cells. Brain, 2017, 140, 2597-2609.
- Bénit P, Chrétien D, Porceddu M, Yanicostas C, Rak M, Rustin P. An Effective, Versatile, and Inexpensive Device for Oxygen Uptake Measurement. J. Clin. Med. 2017 Jun 8;6(6) 58.
- Passemard S., Verloes A., Billette de Villemeur T., Boespflug O., Hernandez K., Laurent M., Isidor B., Alberti C., Pouvreau N., Drunat S., Gérard B., El Ghouzzi V., Gallego J., Elmaleh-Bergès M., Huttner W.B., Eliez S., Gressens P., Schaer M. Abnormal spindle-like microcephaly (ASPM) mutations strongly disrupt neocortex but spare hippocampus and long-term memory. Cortex, 2016, 74, 158-176.
- Izumi K., Brett M., Nishi E., Drunat S., Tan E., Fujiki K., Lebon S., Cham B., Masuda K., Arakawa M., Jacquinet A., Yamazumi Y., Chen S., Verloes A., Okada Y., Nakamura T., Akiyama T., Gressens P., Foo R., Passemard S., Tan E., El Ghouzzi V.*, Shirahige K*. ARCN1 mutations cause a recognizable craniofacial syndrome due to COPI-mediated transport defects. Am. J. Hum. Genet., 2016, 99, 451-459.
- Harding B.N., Moccia A., Soukarieh O., Tubeuf H., Drunat S., Chitty L.S., Verloes A., Gressens P., El Ghouzzi V., Joriot S., Passemard S., Di Cunto F., Martins A., Bielas S.L. Mutations in Citron Kinase cause recessive microlissencephaly with multinucleated neurons. Am. J. Hum. Genet., 2016, 99, 511-520.
- El Ghouzzi V., Bianchi F.T., Molineris I., Mounce B.C., Berto G.E., Rak M., Lebon S., Aubry L., Tocco C., Gai M., Chiotto A.M.A., Sgrò, Pallavicini G., Simon-Loriere E., Passemard S., Vignuzzi M., Gressens P., Di Cunto F. ZIKA Virus elicits P53 activation and genotoxic stress in human neural progenitors similar to mutations involved in severe forms of genetic microcephaly. Cell Death Dis., 2016, 7, e2440.
Contacts
Vincent El Ghouzzi, PhD, DR2 CNRS
UMR Inserm 1141 – NeuroDiderot
Hôpital Robert Debré
48 boulevard Sérurier
75019 Paris
vincent.elghouzzi@inserm.fr
Sandrine Passemard, MD PhD, PR Université Paris Cité
Service de Génétique et UMR Inserm 1141 – NeuroDiderot
Hôpital Robert Debré
48 boulevard Sérurier
75 019 Paris
sandrine.passemard@inserm.fr
À lire aussi

Séminaire scientifique de Xavier Leinekugel le jeudi 22 janvier 2026 (11h).
Nous aurons le plaisir d’accueillir le Dr. Xavier Leinekugel de l'institut de Neurobiologie de la Méditerranée (INMED), Marseille pour un séminaire intitulé: Conséquences potentielles de perturbations du développement de l'inhibition périsomatique de l'hippocampe sur...

Séminaire scientifique d’Alexandra Benchoua le jeudi 16 Avril 2026 (11h).
Nous aurons le plaisir d’accueillir le Dr. Alexandra Benchoua de l'institut I-Stem pour un séminaire intitulé: Modèles de cellules souches pluripotentes humaines pour le criblage à haut débit de molécules thérapeutiques et la médecine de précision dans les TND....

Séminaire scientifique Dr. Clément Apelian le jeudi 19 février 2026 (11h).
Nous aurons le plaisir d’accueillir le Dr. Clément Apelian du laboratoire Laboratoire PRHySME pour un séminaire intitulé: L'hypnose au-delà du fantasme - défis fondamentaux et intérêt clinique 20260219 séminaire Clément Alepian

Séminaire scientifique Pr. Raul Chavez-Valdez le jeudi 12 février 2026 (14h).
Nous aurons le plaisir d’accueillir le Pr. Raul Chavez-Valdez de l'université de Baltimore pour un séminaire intitulé: Synaptic Plasticity following Neonatal Hypoxic-Ischemic Brain Injury 20260212 séminaire Raul Chavez english ...
