Étude de l’implication des cellules microgliales dans la physiopathologie des épilepsies chez le poisson zèbre
Groupe Nadia Soussi-Yanicostas
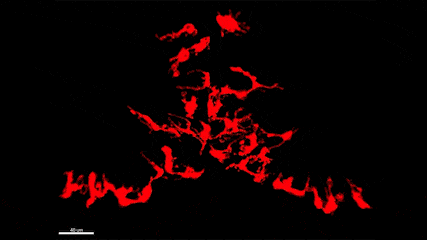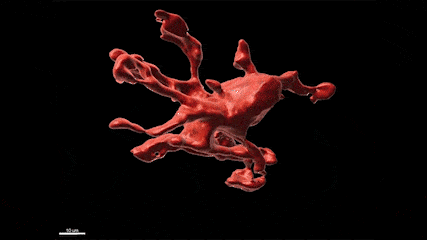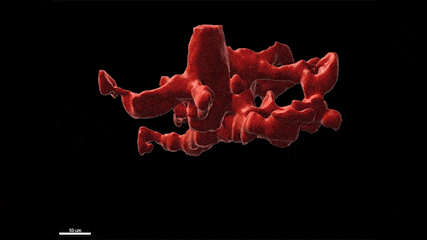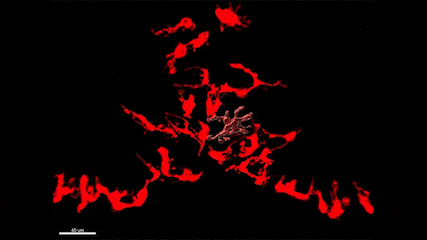
L’épilepsie est l’un des troubles neurologiques les plus fréquents qui affecte plus de 65 millions de personnes dans le monde. De plus, si de nombreux médicaments antiépileptiques (MAE) sont aujourd’hui disponibles, un tiers des patients résiste à ces traitements, faisant de la découverte de nouvelles cibles thérapeutiques et de nouveaux MAE, un besoin urgent et un problème majeur de santé publique. En particulier, bien qu’il soit connu depuis plus de 20 ans que les crises d’épilepsie provoquent une neuroinflammation massive du cerveau qui est causée par l’activation des microglies, les marcrophages résidents du cerveau, les possibilités thérapeutiques offertes par ces cellules ont été peu étudiées à ce jour. Plus généralement, le rôle de ces cellules dans la physiopathologie de l’épilepsie et les conséquences de leur activation à court, moyen et long terme restent mal compris. Dans ce contexte, le groupe de Nadia Soussi-Yanicostas utilise le poisson zèbre comme modèle pour mieux comprendre le rôle ces cellules dans l’épilepsie. La pertinence du poisson zèbre comme modèle d’étude de l’épilepsie est démontrée par les cribles thérapeutiques récents qui ont été réalisés avec ce modèle et qui ont conduit à la découverte de nouveaux MAE, comme le clémizole qui est maintenant en essai clinique de phase III. Dans notre équipe, nous tirons avantage de la transparence de l’embryon de poisson zèbre pour étudier la réponse des microglies aux crises in vivo chez plusieurs mutants qui présentent des crises épileptiformes (les mutations des gènes scn1Lab, garbrg2, gabra1 ou depdc5, responsables du syndrome de Dravet), en utilisant l’imagerie en temps réel de la microglie combinée avec l’imagerie calcique des neurones, les qRT-PCR, l’ablation de la microglie et l’étude du comportement des larves. Nous étudions également la réponse de la microglie suite à une intoxication du système nerveux central par les pesticides organophosphorés.
Nos travaux indiquent que la manipulation pharmacologique de la réponse des microglies est une approche nouvelle et prometteuse, pour réduire l’impact dévastateur de la neuroinflammation de la microglie sur les neurones cérébraux, que ce soit dans le cas des maladies neurodéveloppementales (telles que les encéphalopathies épileptiques infantiles comme le syndrome de Dravet) ou dans celui de l’exposition à des neurotoxiques environnementaux (tels que les organophosphorés).
Travaux récents
Nous avons démontré qu’il existe un déséquilibre de la balance synaptique en faveur de l’excitation dans le cerveau de trois mutants différents du poisson zèbre qui présentent des crises épileptiformes; les mutants scn1Lab (Brenet A. et al. Cells 2019), gabra1 (Samarut E. et al. Epilepsia 2018) et depdc5 (Swaminathan A. et al. Curr. Biol. 2018). Au cours de nos travaux sur le mutant scn1Lab, nous avons également montré la parfaite corrélation entre les enregistrements électro-encéphalographiques de l’activité cérébrale et l’imagerie calcique in vivo (Brenet A. et al. Cells 2019).
En utilisant un modèle in vivo de neuroinflammation dans l’embryon de poisson zèbre, nous avons d’abord montré que la carbétocine, un analogue de l’oxytocine, a de forts effets anti-inflammatoires via son action sur les microglies (Mairesse J. et al. Glia 2019). Plus récemment, nous avons montré que cet analogue de l’oxytocine diminue le nombre et l’intensité des crises chez les embryons scn1Lab via son action anti-inflammatoire sur les microglies (Brenet A. et al. En prép)
Nous avons établi le premier modèle d’empoisonnement de l’embryon de poisson zèbre par le DFP, un organophosphoré proche du gaz neurotoxique sarin. Nous avons ainsi confirmé la neurotoxicité de ce composé ainsi que ses effets épileptogènes (Brenet A. et al. Sci. Rep. 2020), qui induisent une neuroinflammation massive des microglies (Maupu C. et al. Neurobiol. Dis. 2021; Somkhit J. et al. Int. J. Mol. Sci. 2022). Nous étudions actuellement de nouveaux antidotes qui protégeraient de l’empoisonnement aux organophosphoré.
Nous avons mis en évidence que le bixafen, un fongicide de la famille des inhibiteurs de la succinate déshydrogénase (SDHi) largement utilisé par les agriculteurs, présente une neurotoxicité développementale pour l’embryon de poisson zèbre à des doses environnementalement pertinentes. Cette toxicité se traduit par une microcéphalie et par une désorganisation des axones moteurs (Brenet A. et al. Chemosphere 2021). Ces résultats ont fait l’objet d’un communiqué dans le journal du CNRS (CNRS, https://urlz.fr/j12X) et d’un article dans le quotidien Le Monde du 21/11/2020. Enfin, ce travail et les dangers que représentent les SDHi dont la toxicité demeure peu étudiée, nous ont conduit à réaliser une revue des études de toxicologie des SDHi réalisées à ce jour chez le poisson zèbre (Yanicostas C. and Soussi-Yanicostas N. Int. J. Mol. Sci. 2021). Dans la continuité de ce travail, nous étudions actuellement les effets transgénérationnels de ces pesticides et les modifications épigénétiques impliquées.
Plus récemment, nous avons montré pour la première fois in vivo que les crises épileptiformes chez le mutant scn1Lab induisent une neuroinflammation d’origine microgliale, mais surtout, qu’en absence de microglies, les crises sont plus intenses et plus fréquentes, indiquant qu’en dépit de la neuroinflammation qu’elles induisent, les microglies ont un rôle neuroprotecteur (Brenet A. et al. En prép. hal-03745018v2). Nous étudions actuellement la réponse des microglies aux crises épileptiformes en utilisant le mutant gabrg2 chez lequel les crises peuvent être induites par un flash lumineux, permettant de suivre in vivo la dynamique de la réponse de ces cellules aux crises.
Au niveau technologique, nous avons mis au point une méthode simple et peu coûteuse qui permet de mesurer en temps réel la consommation d’O2 chez des embryons vivants de poisson zèbre (Somkhit J. et al. Zebrafish 2020).
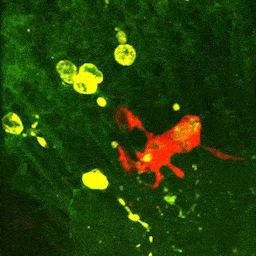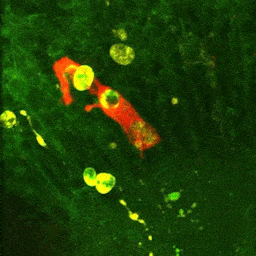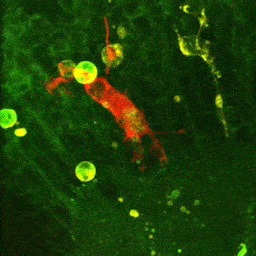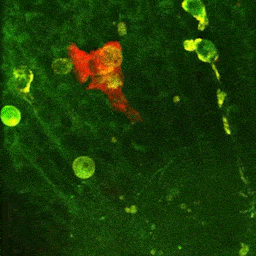
Vidéo montrant la phagocytose de cellules mortes par une microglie en temps réel dans le cerveau d’un embryon de poisson zèbre (zebrafish) âgé de 4 jours.
La microglie (rouge) attrape les cellules mortes (jaunes) par ses prolongements puis les digèrent pour nettoyer le cerveau (Travaux de l’équipe de Nadia Soussi-Yanicostas
Contacts
Nadia Soussi-Yanicostas
NeuroDiderot, Inserm U1141
Hôpital Robert Debré
48 boulevard Sérurier
75019 Paris
nadia.soussi@inserm.fr
À lire aussi
Offre d’emploi au sein du groupe Génomique intégrative du Neurodéveloppement
Le groupe Génomique intégrative du Neurodéveloppement est à la recherche d'un postdoctorant. Découvrez l'opportunité et postulez ici : Post-doc Bio-informatique Integrative

Programme de recherche Sleep2Develop
Le programme Sleep2Develop étudie le rôle du sommeil en tant que promoteur du neurodéveloppement et identifie les déterminants du sommeil pour le développement de l'enfant. Cela peut être reformulé comme Sleep(to)Develop ? ou Sleep(to)Develop ! [sommeil pour se...

L’Institut Robert-Debré du Cerveau de l’Enfant est lauréat de l’appel à projets Institut Hospitalo-universitaire (IHU).
L’Institut Robert-Debré du Cerveau de l’Enfant est lauréat de l’appel à projets Institut Hospitalo-universitaire (IHU). Il porte l’innovation en faveur du développement cognitif de chaque enfant. L’Institut Robert-Debré du Cerveau de l’Enfant : un Institut...

Offre d’emploi ingénieur en expérimentation et instrumentation biologique
Dans le cadre du développement de ses activités, la plateforme NemoClinics recrute un ingénieur d'études en expérimentation et instrumentation biologique. Pour voir l'offre et postuler, rendez-vous ici : U 1141 -Ingénieur-e en expérimentation et instrumentation...
